Medicamentos: como comunicar efeitos adversos

Teve dores de barriga, ou comichão na pele, ou caiu-lhe o cabelo depois de usar um medicamento, e pensa que este é o responsável? Avise o Infarmed, através do Portal RAM, por carta ou telefone, e ajude a melhorar a segurança dos fármacos.
Os benefícios da maioria dos medicamentos são inquestionáveis, mas também é preciso não esquecer que nenhum é totalmente inócuo. Quando um fármaco entra no mercado, o seu perfil de segurança não é totalmente conhecido. Os ensaios clínicos incluem poucos participantes comparativamente aos milhões que vão usar o produto, deixam de fora alguns grupos, como crianças e idosos, e não contemplam todas as situações de utilização real (conjugação de doenças e de medicamentos, por exemplo).
- suspeitas de reações adversas graves e ligeiras, previstas ou não no folheto informativo;
- erros médicos relacionados com medicamentos, como prescrição errada e troca de produtos;
- tomas em dose excessiva;
- tomas não intencionais em condições não previstas no folheto informativo;
- utilização intencional em situações diferentes das previstas no folheto (com objetivos médicos ou não).
Como relatar efeitos adversos dos medicamentos?
O paciente (ou alguém em seu nome) pode fazer a participação através do Portal RAM do Infarmed (veja o passo-a-passo). Tenha o medicamento que suspeita que lhe causou a reação adversa junto a si, pois terá de fornecer alguns dados sobre o mesmo, e muna-se de alguma paciência para preencher os vários passos.
Pode também imprimir e preencher a ficha de notificação para utentes e enviá-la pelo correio, para Infarmed, Direção de Gestão do Risco de Medicamentos, Parque de Saúde de Lisboa, Av. do Brasil, n.º 53, 1749-004 Lisboa. As comunicações dos consumidores, dos profissionais de saúde e da indústria farmacêutica são registadas e analisadas pelo Infarmed, autoridade que controla os medicamentos em Portugal. As suspeitas de reações graves são comunicadas à EudraVigilance, estrutura da Agência Europeia do Medicamento (em inglês, European Medicines Agency – EMA), no prazo de 15 dias. Os restantes efeitos devem ser enviados até 90 dias.
Quando considerarem que a gravidade ou o volume das queixas o justificam, as autoridades reúnem todos os dados disponíveis na literatura sobre o assunto e podem pedir mais informação e estudos à indústria para verificar se o efeito se deve efetivamente ao medicamento. Se os dados confirmarem as suspeitas, dependendo da gravidade, as autoridades podem ordenar a comunicação do risco aos profissionais e aos utentes, alteração do folheto informativo, mudança de estatuto do medicamento (venda livre passa a prescrição obrigatória) e suspensão ou retirada do mercado.
Consumidor tem acesso à informação sobre reações adversas a medicamentos
O utente tem uma cópia-resumo da notificação e fica com o número de submissão. Precisa também de concordar com o tratamento de informação e confidencialidade dos dados antes de submeter a notificação. Tem ainda de concordar com a partilha dos dados.
Os cidadãos europeus podem obter informações sobre as suspeitas de reações adversas a medicamentos de 1700 substâncias ativas contidas em fármacos aprovados na União Europeia (UE) através de www.adrreports.eu. Este site é da responsabilidade da Agência Europeia do Medicamento (EMA) e anteriormente continha apenas informações sobre suspeitas de reações adversas relatadas com medicamentos autorizados a nível comunitário. O alargamento da informação permite agora ao público conhecer dados relevantes para medicamentos aprovados pelas autoridades nacionais na UE.
Passo-a-passo
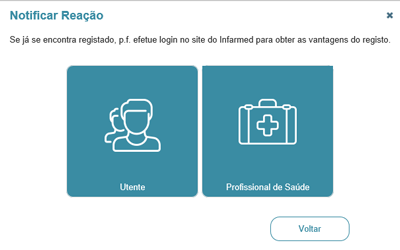
1. Depois de clicar em “Portal RAM – Registo de reações adversas a medicamentos” e selecionar a opção "Utente", tem de assinalar a opção que respeita à origem às reações adversas que vai descrever.

2. Preencha o formulário de cada um dos separadores.
A barra superior indica em que fase do processo de notificação se encontra. Permite modificar o que preencheu, se clicar sobre cada uma das fases.

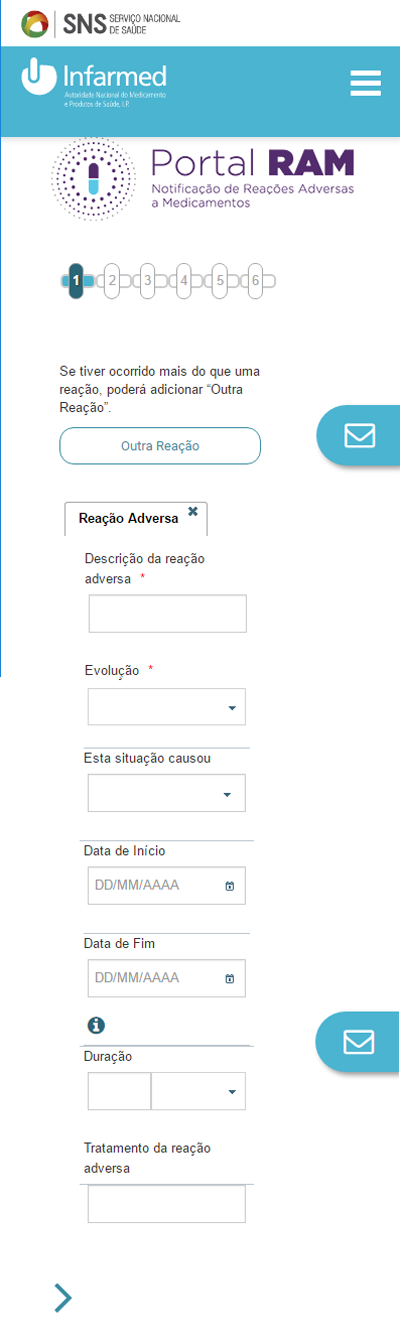
3. Nesta fase, deve descrever a reação causada pelo medicamento. Pode adicionar quantas quiser. Para poder continuar, tem de preencher a evolução da reação adversa. Para avançar, carregue na seta da barra superior (se estiver a preencher a partir de um computador) ou na seta final (se estiver a preencher através de um smartphone ou de um tablet).
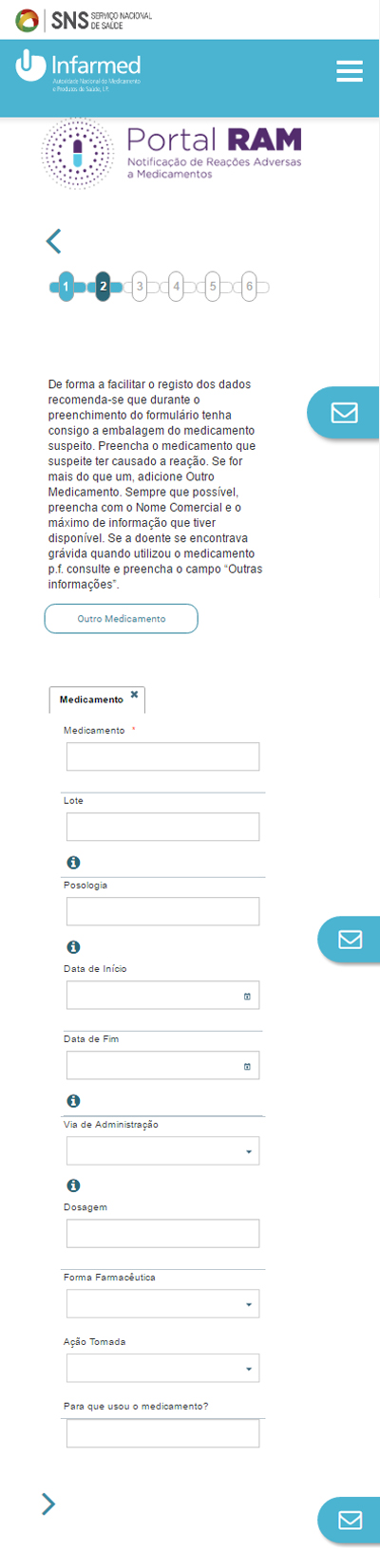
4. Tem de identificar o medicamento em causa, mas o sistema mostra uma lista com sugestões de nomes comerciais e de princípios ativos.
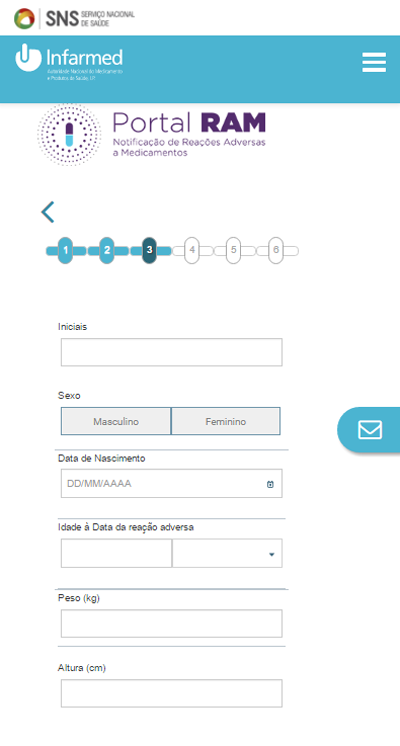
A pessoa que notifica pode não ser o doente. Será o caso dos pais de uma criança, por exemplo. Nessa situação, é necessário preencher o nome, o e-mail e o telefone do notificador. Responda também se já reportou a situação a um médico. Se sim, terá de dizer se autoriza que o profissional de saúde seja ou não contactado.
O formulário permite incluir outras informações. Por exemplo, se está a tomar outro medicamento. Pode ainda anexar análises ou exames relacionados com o diagnóstico da reação adversa.
|
O conteúdo deste artigo pode ser reproduzido para fins não-comerciais com o consentimento expresso da DECO PROTeste, com indicação da fonte e ligação para esta página. Ver Termos e Condições. |
Os benefícios da maioria dos medicamentos são inquestionáveis, mas também é preciso não esquecer que nenhum é totalmente inócuo. Quando um fármaco entra no mercado, o seu perfil de segurança não é totalmente conhecido. Os ensaios clínicos incluem poucos participantes comparativamente aos milhões que vão usar o produto, deixam de fora alguns grupos, como crianças e idosos, e não contemplam todas as situações de utilização real (conjugação de doenças e de medicamentos, por exemplo).
- suspeitas de reações adversas graves e ligeiras, previstas ou não no folheto informativo;
- erros médicos relacionados com medicamentos, como prescrição errada e troca de produtos;
- tomas em dose excessiva;
- tomas não intencionais em condições não previstas no folheto informativo;
- utilização intencional em situações diferentes das previstas no folheto (com objetivos médicos ou não).
Como relatar efeitos adversos dos medicamentos?
O paciente (ou alguém em seu nome) pode fazer a participação através do Portal RAM do Infarmed (veja o passo-a-passo). Tenha o medicamento que suspeita que lhe causou a reação adversa junto a si, pois terá de fornecer alguns dados sobre o mesmo, e muna-se de alguma paciência para preencher os vários passos.
Pode também imprimir e preencher a ficha de notificação para utentes e enviá-la pelo correio, para Infarmed, Direção de Gestão do Risco de Medicamentos, Parque de Saúde de Lisboa, Av. do Brasil, n.º 53, 1749-004 Lisboa. As comunicações dos consumidores, dos profissionais de saúde e da indústria farmacêutica são registadas e analisadas pelo Infarmed, autoridade que controla os medicamentos em Portugal. As suspeitas de reações graves são comunicadas à EudraVigilance, estrutura da Agência Europeia do Medicamento (em inglês, European Medicines Agency – EMA), no prazo de 15 dias. Os restantes efeitos devem ser enviados até 90 dias.
Quando considerarem que a gravidade ou o volume das queixas o justificam, as autoridades reúnem todos os dados disponíveis na literatura sobre o assunto e podem pedir mais informação e estudos à indústria para verificar se o efeito se deve efetivamente ao medicamento. Se os dados confirmarem as suspeitas, dependendo da gravidade, as autoridades podem ordenar a comunicação do risco aos profissionais e aos utentes, alteração do folheto informativo, mudança de estatuto do medicamento (venda livre passa a prescrição obrigatória) e suspensão ou retirada do mercado.
Consumidor tem acesso à informação sobre reações adversas a medicamentos
O utente tem uma cópia-resumo da notificação e fica com o número de submissão. Precisa também de concordar com o tratamento de informação e confidencialidade dos dados antes de submeter a notificação. Tem ainda de concordar com a partilha dos dados.
Os cidadãos europeus podem obter informações sobre as suspeitas de reações adversas a medicamentos de 1700 substâncias ativas contidas em fármacos aprovados na União Europeia (UE) através de www.adrreports.eu. Este site é da responsabilidade da Agência Europeia do Medicamento (EMA) e anteriormente continha apenas informações sobre suspeitas de reações adversas relatadas com medicamentos autorizados a nível comunitário. O alargamento da informação permite agora ao público conhecer dados relevantes para medicamentos aprovados pelas autoridades nacionais na UE.
1. Depois de clicar em “Portal RAM – Registo de reações adversas a medicamentos” e selecionar a opção "Utente", tem de assinalar a opção que respeita à origem às reações adversas que vai descrever.

2. Preencha o formulário de cada um dos separadores.

A barra superior indica em que fase do processo de notificação se encontra. Permite modificar o que preencheu, se clicar sobre cada uma das fases.

3. Nesta fase, deve descrever a reação causada pelo medicamento. Pode adicionar quantas quiser. Para poder continuar, tem de preencher a evolução da reação adversa. Para avançar, carregue na seta da barra superior (se estiver a preencher a partir de um computador) ou na seta final (se estiver a preencher através de um smartphone ou de um tablet).

4. Tem de identificar o medicamento em causa, mas o sistema mostra uma lista com sugestões de nomes comerciais e de princípios ativos.


A pessoa que notifica pode não ser o doente. Será o caso dos pais de uma criança, por exemplo. Nessa situação, é necessário preencher o nome, o e-mail e o telefone do notificador. Responda também se já reportou a situação a um médico. Se sim, terá de dizer se autoriza que o profissional de saúde seja ou não contactado.
O formulário permite incluir outras informações. Por exemplo, se está a tomar outro medicamento. Pode ainda anexar análises ou exames relacionados com o diagnóstico da reação adversa.

