Vacinas contra a covid-19: quais são utilizadas em Portugal?
A campanha de vacinação para a Covid-19 começa a 23 de setembro. Saiba quais são as principais características da Comirnaty LP.8.1, a vacina disponível em Portugal para combater o SARS-CoV-2.

Em Portugal, a vacina contra a covid-19 disponível é a Comirnaty LP.8.1. Ainda assim, há duas vacinas autorizadas na União Europeia (UE) para esse efeito e várias versões adaptadas das vacinas existentes.
As vacinas autorizadas na UE são as seguintes:
- Bimervax;
- Comirnaty.
As vacinas adaptadas são versões atualizadas das vacinas existentes concebidas para melhor corresponderem às últimas variantes do vírus SARS-CoV-2 em circulação. Funcionam da mesma forma que as vacinas originalmente autorizadas, mas espera-se que proporcionem uma proteção mais ampla contra diferentes variantes à medida que o vírus SARS-CoV-2 evolui, após a vacinação inicial.
Voltar ao topoQuais as vacinas contra a covid-19 utilizadas em Portugal?
Atualmente, em Portugal, é utilizada apenas uma vacina, a Comirnaty LP.8.1, com diferentes dosagens.
Voltar ao topoQuantas doses tenho de tomar?
A vacinação primária contra a covid-19 decorre durante todo o ano e está recomendada aos seguintes grupos:
- Pessoas com idade igual ou superior a 18 anos;
- Pessoas com idade entre os 6 meses e os 17 anos com condições de imunossupressão grave (neoplasia maligna ativa, transplantação, imunossupressão) ou mediante avaliação clínica individual.
Esquema de vacinação
Os esquemas vacinais primários recomendados dependem da idade, das especificidades de cada vacina e dos critérios de elegibilidade:
- Dos 6 meses a 4 anos de idade: 3 doses com Comirnaty LP.8.1 3µg.
- Dos 5 a 11 anos de idade: 1 dose única com Comirnaty LP.8.1 10µg;
- A partir dos 12 anos de idade: 1 dose única, com Comirnaty LP.8.1 30µg;
As vacinas contra a covid-19 são eficazes?
Os dados mostram que a Comirnaty provoca a produção de anticorpos contra o SARS-CoV-2 que podem conferir proteção contra a covid-19. Os ensaios principais com a Comirnaty revelam que a vacina tem uma elevada eficácia em todos os grupos etários. As pessoas não vacinadas continuam a correr um risco muito maior de vir a desenvolver doenças graves associadas à covid-19. No que respeita à transmissão, o impacto da vacina é modesto.
Nos ensaios clínicos realizados, verificou-se uma redução de 95% no número de casos sintomáticos de covid-19 em pessoas que receberam a vacina em comparação com as pessoas que receberam uma injeção de placebo. Ou seja, a vacina demonstrou uma eficácia de 95 por cento. Essa eficácia foi também demonstrada nos participantes do estudo com risco de desenvolver formas graves de covid-19, incluindo doentes com asma, doença pulmonar crónica, diabetes, tensão arterial alta ou obesidade.
A imunidade pode reduzir-se mais rapidamente em pessoas mais velhas, que têm condições médicas subjacentes ou que têm um elevado nível de exposição ao vírus. Daí as recomendações para reforço vacinal nestes grupos populacionais.
As doses subsequentes, incluindo as doses de reforço da vacina da covid-19, levam a um aumento dos níveis de anticorpos contra o SARS-CoV-2. Os dados disponíveis indicam que as vacinas adaptadas especificamente para visar as estirpes circulantes do vírus provocam uma forte resposta imunitária contra essas estirpes. Ainda assim, como com qualquer medicamento, nenhuma vacina é isenta de efeitos indesejáveis.
Ainda não é conhecida a duração da proteção contra a covid-19 dada pelas vacinas aprovadas.
Voltar ao topoVacinas feitas em tempo recorde, mas não saltaram passos
O desenvolvimento das vacinas contra a covid-19 foi cumprido em tempo recorde, aplicando todos os conhecimentos atuais sobre o desenvolvimento de vacinas. Nenhuma fase foi eliminada ou reduzida, mas conseguiu-se implementá-las em paralelo. O diálogo precoce e contínuo entre a indústria farmacêutica e um grupo de peritos em regulamentação da EMA foi importante para agilizar todo o processo.
Foram levados a cabo os mesmos tipos de estudos que são realizados para a aprovação dos outros medicamentos e realizada uma avaliação rigorosa da qualidade, segurança e eficácia das vacinas. Todas foram testadas num elevado números de pessoas. O benefício esperado no momento da aprovação inicial das vacinas é a redução de doença sintomática de covid-19.

Fases de desenvolvimento da vacina
Numa fase pré-clínica, foram realizados estudos com modelos informáticos, experiências laboratoriais e em modelos animais, de forma a determinar o potencial benéfico e seguro contra a covid-19.
A primeira fase dos ensaios clínicos tem por base a administração de doses variáveis em 20 a 100 voluntários saudáveis para confirmar a segurança e determinar a eficácia.
Na segunda fase do ensaio, já apenas com uma dose selecionada, a amostra de voluntários aumenta: 1000 a 2000. Esta amostra aproxima-se mais à população que vai receber a vacina, no que às características etárias, fisiológicas e epidemiológicas diz respeito. No entanto, não tem habitualmente dimensão suficiente para a prova de eficácia e segurança final.
A prova de eficácia e segurança finais dá-se na terceira fase. São realizados estudos que servem de base à autorização de introdução da vacina no mercado. Nesta fase, a amostra ronda as dezenas de milhares de doentes. A eficácia é determinada pela redução de infeções nos indivíduos tratados (grupo experimental), quando comparada com a dos que não levam a vacina em estudo (grupo de controlo).
Os ensaios clínicos são essenciais para a aprovação do novo medicamento pelas autoridades competentes. Após a autorização, numa quarta fase, os dados provenientes da utilização do medicamento aprovado são recolhidos e analisados em relatórios periódicos para que seja feita uma nova avaliação e, posteriormente, se necessário, otimizar o uso do medicamento.
Voltar ao topoQue tecnologias são utilizadas nas vacinas?
A vacina Comirnaty contém uma molécula chamada RNA mensageiro (mRNA) com instruções para a produção de uma proteína do SARS-CoV-2, o vírus que causa a covid-19.
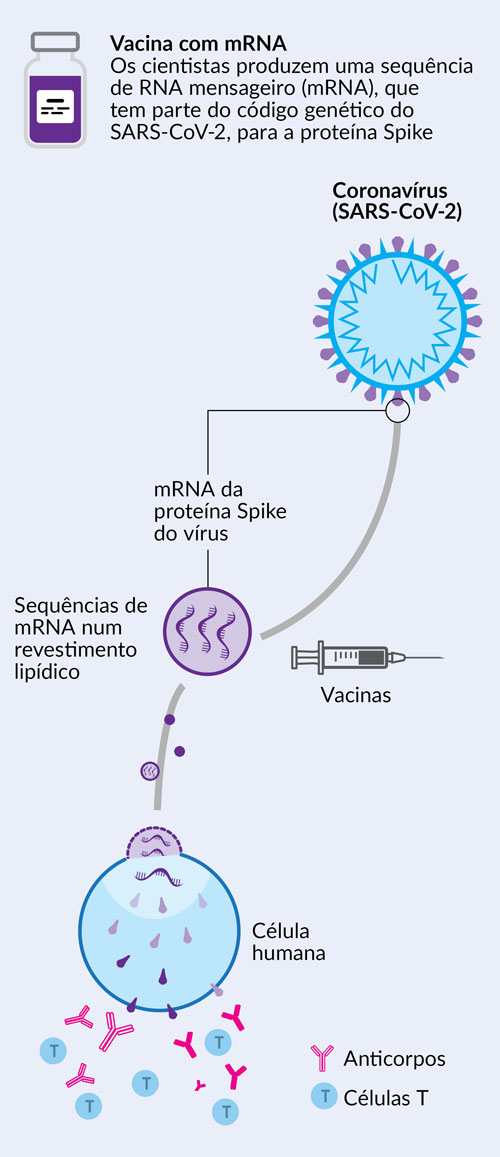
Ao contrário do que algumas notícias deram conta, as vacinas contra a covid-19 não alteram o ADN humano, nem podem causar doença covid-19, dado que não são compostas pelo vírus SARS-CoV-2.
Voltar ao topo|
O conteúdo deste artigo pode ser reproduzido para fins não-comerciais com o consentimento expresso da DECO PROTeste, com indicação da fonte e ligação para esta página. Ver Termos e Condições. |

